Dr Virginie BARRAULT-LANGE – Médecin au service d’Histologie Embryologie de l’Hôpital Cochin
JOURNÉE D’INFORMATION MÉDICALE ET D’ÉCHANGES
12 octobre 2019 – Hôpital Saint-Louis
Le Dr Virginie Barrault-Lange remercie EGMOS de lui avoir fait confiance et d’avoir soutenu ses travaux de recherche. Ses études sont réalisées au sein du laboratoire de Biologie de la Reproduction-CECOS, où sont conservés des gamètes, des embryons et du tissu germinal.
SPERMATOGÉNÈSE ADULTE
 L’histologie est l’étude des tissus.
L’histologie est l’étude des tissus.
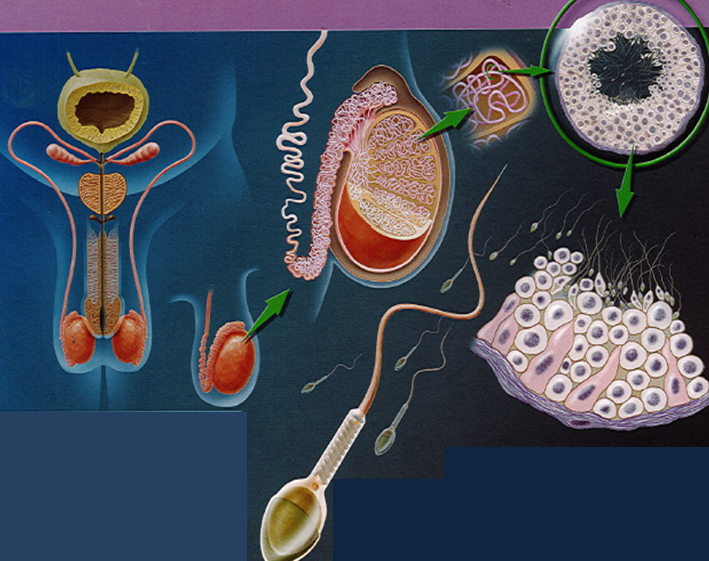
La spermatogénèse a lieu dans le testicule, à l’intérieur d’une pelote de tube recroquevillé sur lui-même (d’une longueur de 50 mètres si on le déroulait).
Les cellules souches (les plus immatures) situées à l’extérieur vont au fur et à mesure se transformer pour se spécialiser. Le spermatozoïde va ensuite se décrocher dans la lumière du tube. A ce stade, il n’est pas encore mobile.
Les traitements de conditionnement pré-greffe, comme la chimiothérapie à forte dose, ont pour effets secondaires de détruire les spermatozoïdes, ainsi que les cellules souches. Or les cellules souches permettent de constituer un stock. La spermatogénèse n’est possible de manière continue que grâce à ce stock. C’est pourquoi la disparition des cellules souches rend la spermatogenèse impossible. La chimiothérapie de conditionnement pré-greffe va donc très probablement rendre le patient stérile : il s’agit de l’une des chimiothérapies les plus risquées pour la fertilité.
PRÉSERVATION DE LA FERTILITÉ DE L’HOMME ADULTE
Les premières banques de sperme ont été créées en 1970. Les spermatozoïdes sont congelés dans l’azote liquide grâce à des paillettes en plastique, sans aucune limitation de durée. Nous savons utiliser des spermatozoïdes congelés puis décongelés pour en faire des embryons qui donneront naissance à des bébés. Mais comment préserver la fertilité de personnes qui ne produisent pas encore de spermatozoïdes ?
PRÉSERVATION DE LA FERTILITÉ DE L’ENFANT
 Les cellules souches sont présentes dans les testicules dès la naissance. En pré-puberté, elles commencent à se multiplier. A la puberté, sous l’effet des hormones, elles vont commencer à produire des spermatozoïdes.
Les cellules souches sont présentes dans les testicules dès la naissance. En pré-puberté, elles commencent à se multiplier. A la puberté, sous l’effet des hormones, elles vont commencer à produire des spermatozoïdes.
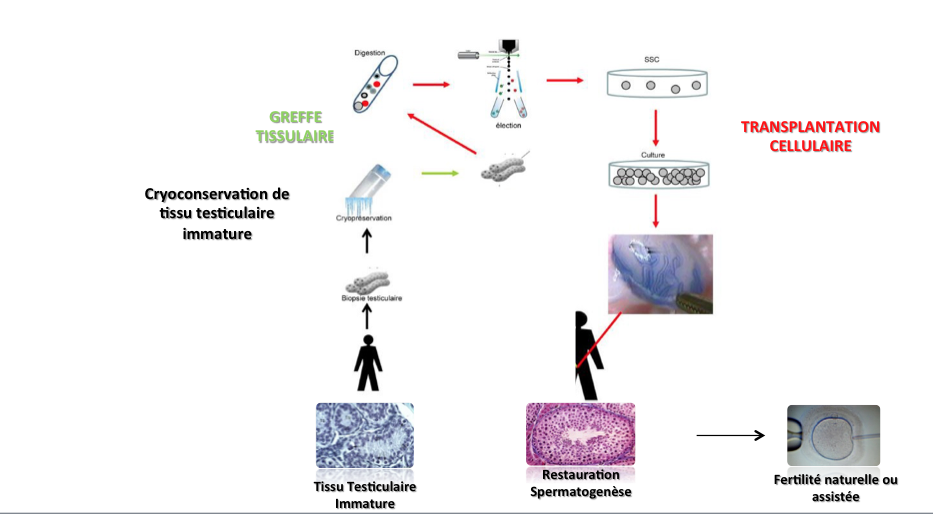
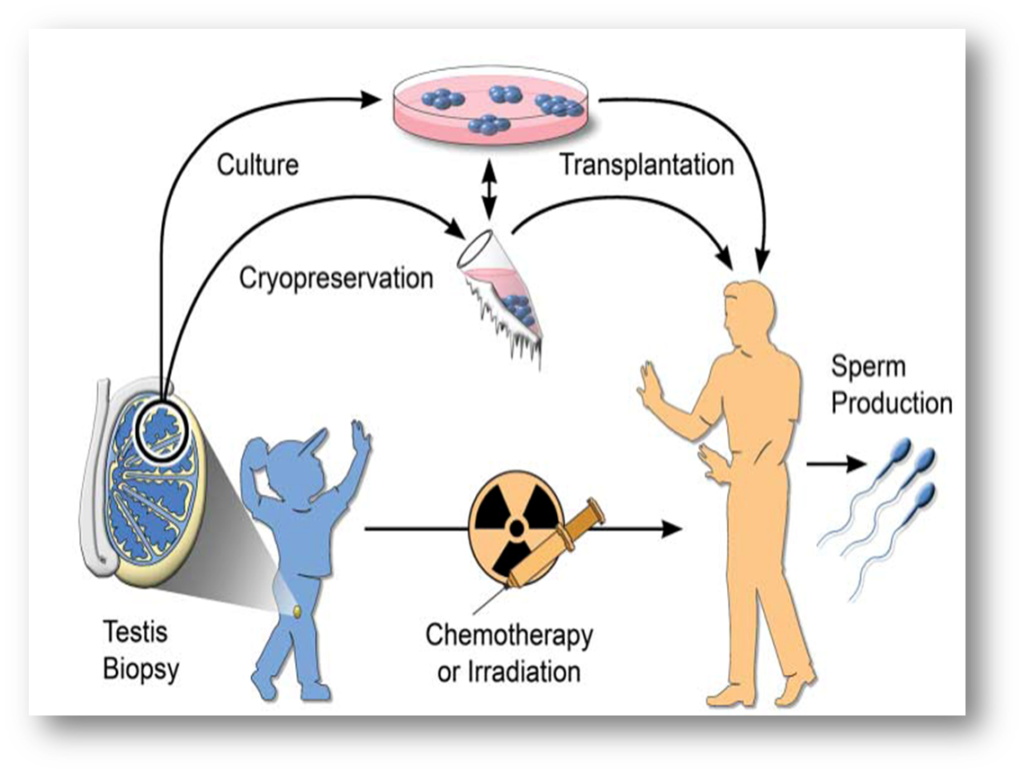
Avant de recevoir le traitement, le tissu est prélevé pour conservation. L’idée est de réutiliser le tissu conservé à l’âge adulte, pour une utilisation autologue.
La loi de bioéthique de 1994 a été révisée en 2004: toute personne atteinte de pathologie ou devant subir une intervention à risque doit au moins être informée des techniques de préservation de sa fertilité. Concernant l’enfant, le prélèvement et la congélation de tissu testiculaire immature sont proposés aux parents.
Par incision de la peau, un échantillon de testicule est prélevé (le testicule grandit peu de la naissance jusqu’à 8 ans). Le prélèvement est transmis au laboratoire, pour être découpé en petits morceaux en présence d’un cryoprotecteur pour protéger les cellules. Un automate de congélation congèle ensuite les cellules pour les conserver. Cette technique a été proposée pour la première fois en France en 2007.
Aucune réutilisation du tissu testiculaire immature n’a encore permis de restaurer la fertilité d’un enfant devenu adulte. Cette technique demeure donc encore au stade expérimental. Elle est cependant proposée dès à présent aux enfants dans l’espoir de progrès scientifique futurs, pour que le tissu testiculaire puisse être réutilisé plus tard. Le prélèvement de tissu testiculaire est par ailleurs inscrit dans le Plan cancer et est associé à des programmes de recherche clinique.
En France, nous pensons qu’il existe des enfants qui pourraient bénéficier de cette technique mais qui ne se le voient pas proposer, faute d’information. Depuis le début de l’activité, 400 enfants en ont bénéficié, dont 32% dans le cadre d’une leucémie aiguë.
MODALITÉS DE RESTAURATION
Le défi à relever est le suivant : réussir à décongeler le tissu immature et le rendre mature, ce qui est très complexe. Il convient d’offrir à ce tissu, qui n’est plus présent dans le corps, les conditions pour qu’il puisse se différencier. Or pour ce faire, il ne suffit pas d’injecter de la FSH (hormone présente dans le cerveau).
- In vitro (au laboratoire)
Les petits fragments sont cultivés pour qu’ils se différencient. L’intérêt pour les patients leucémiques est d’éviter que des cellules malignes soient réinjectées dans les testicules. Il convient d’arriver à connaître tous les marqueurs nécessaires pour que le processus fonctionne.
Cette technique fonctionne chez la souris, qui représente un excellent modèle de travail, malgré les différences par rapport à l’humain. Les chercheurs ont placé des petits fragments de tissu dans des boîtes de culture, en introduisant les hormones dans le milieu. Trois mois après, le tissu est entré en différentiation. Après fracture des tubes, les spermatozoïdes ont été récoltés puis utilisés pour réaliser une fécondation in vitro. Cette fécondation a produit des embryons, qui ont été transférés dans des souris pour donner naissance à des petits.
Concernant les données chez l’humain, une startup lyonnaise a réussi à réunir les conditions pour produire des spermatozoïdes en petite quantité, sans pour autant obtenir de différentiation du tissu immature en tissu mature.
Par ailleurs, une équipe belge a mis au point en 2017 les conditions expérimentales in vitro pour cultiver du tissu testiculaire pré-pubère humain et d’en préserver la structure. Ces cellules expriment des marqueurs de maturation, sans pour autant produire de spermatozoïdes.
La technique In vitro est donc intéressante car elle évite le risque de réintroduction de la maladie. Il convient de mieux comprendre le processus pour reproduire les conditions de maturation des cellules immatures.
- In vivo
La technique consiste à n’extraire du tissu que des cellules souches. Ces cellules ont la capacité de se multiplier. L’intention est de les réinjecter dans les testicules de l’homme adulte, pour qu’elles aillent se nicher dans le tube puis engendrer la spermatogenèse.
Une fois injectées dans le corps, les cellules sont soumises à l’environnement (FSH, testostérone…), ce qui va les influencer et ainsi leur permettre d’arriver à maturation. La preuve du concept a été réalisée dans les années 1990.
Une autre stratégie consiste à prendre un fragment entier de tissu, le recoudre dans le testicule, le revasculariser, puis le baigner d’hormones pour obtenir une différenciation des cellules. Les spermatozoïdes obtenus sont alors placés dans un ovocyte pour produire un embryon in vitro. Cette technique est très bien maîtrisée pour les couples infertiles. En l’espèce cependant, l’élément manquant demeure le spermatozoïde.
EXPÉRIENCE SUR LE SINGE
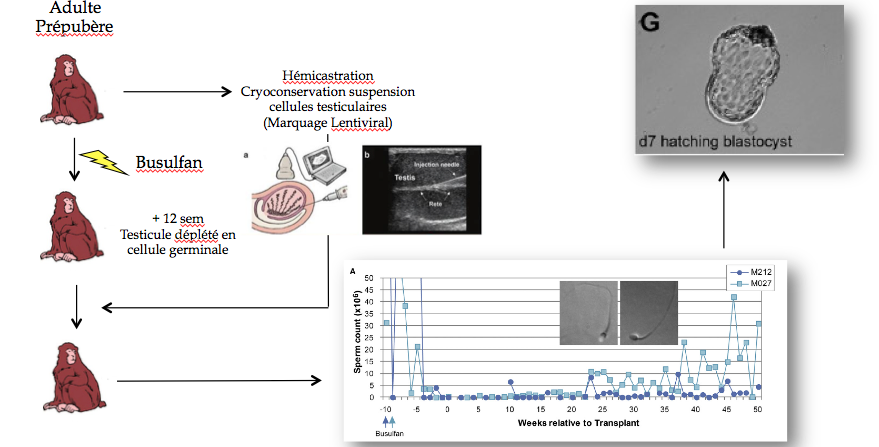
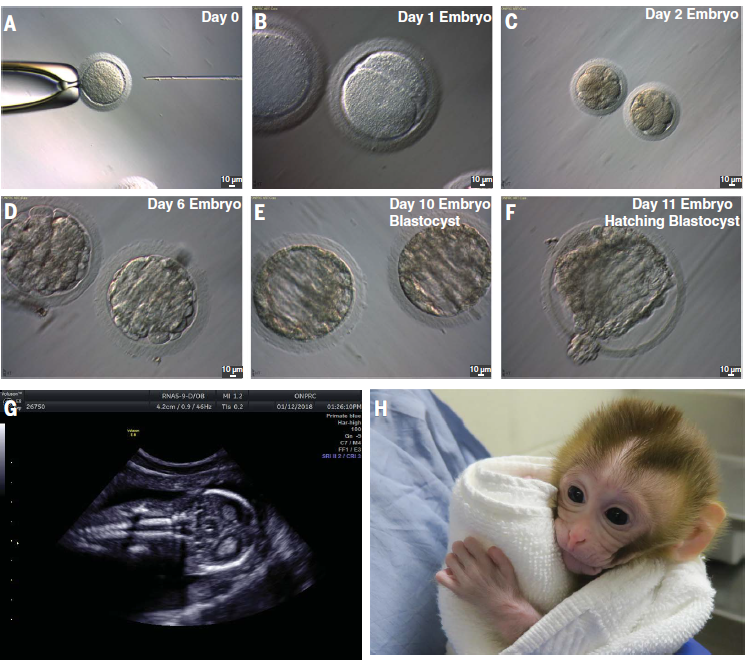 Une xénogreffe a été réalisée : un tissu de singe a été greffé sur le dos d’une souris. Le greffon a grossi, des spermatozoïdes en ont été extraits, pour les réinjecter sur une femelle singe, ce qui a donné des bébés singes. Pour l’application chez l’homme en revanche, le tissu ne pourra pas être greffé sur des souris.
Une xénogreffe a été réalisée : un tissu de singe a été greffé sur le dos d’une souris. Le greffon a grossi, des spermatozoïdes en ont été extraits, pour les réinjecter sur une femelle singe, ce qui a donné des bébés singes. Pour l’application chez l’homme en revanche, le tissu ne pourra pas être greffé sur des souris.
Un article a été publié dans la revue Science à propos d’une autogreffe chez le macaque adulte. Un fragment de testicule a été prélevé sur le singe lorsque celui-ci était prépubère. Ce fragment lui a été regreffé à l’âge adulte et la taille de ce fragment a par la suite augmenté. Quelques mois plus tard, des spermatozoïdes ont pu être extraits puis transférés par micro-injections pour féconder un œuf. L’embryon a été transféré à une femelle pour donner naissance à un petit singe.
Selon le docteur Barrault-Lange, il s’agit de la technique qui fonctionnera le mieux chez l’humain. Encore faudra-t-il s’assurer qu’on ne fera pas prendre de risque au patient.
Une autre expérience a été réalisée chez des singes adultes et pré-pubères. Un testicule entier est retiré au singe. Les cellules sont conservées en suspension. Les singes sont ensuite traités au Busulfan qui les rend complètement stériles. Douze semaines après le traitement, on vérifie que le testicule est dépourvu de cellule souche. La suspension cellulaire est alors réinjectée à la sortie du testicule. La spermatogénèse réapparait au bout de 20 semaines. Les spermatozoïdes sont enfin injectés dans des œufs pour produire un embryon.
Malheureusement, les chercheurs n’ont pas pu transférer l’embryon obtenu, faute de moyens financiers suffisants. Il s’agit cependant d’une très grande avancée : il a en effet été vérifié que le fait de transplanter les cellules souches permettait de restaurer la fertilité d’un animal stérile.
QUELLE TECHNIQUE PRIVILÉGIER ?
Auc une technique ne doit être privilégiée, elles sont toutes importantes car les patients sont tous différents.
une technique ne doit être privilégiée, elles sont toutes importantes car les patients sont tous différents.
En fonction de la pathologie rencontrée, une technique sera indiquée plutôt qu’une autre.
GREFFE
La greffe maintient la cellule souche dans son environnement naturel. Concernant le modèle humain masculin, elle ne donne pas encore de résultat. En revanche, la greffe de cortex ovarien (partie externe de l’ovaire contenant les gamètes) chez la femme permet de donner des naissances. Il existe donc un espoir que cette technique puisse un jour fonctionner aussi chez le sujet masculin.
En raison du risque de maladie résiduelle, cette technique ne sera pas indiquée pour certains patients. Certaines équipes injectent en revanche du cortex ovarien à des patientes leucémiques, dans le cas où la maladie résiduelle n’est pas détectée dans le greffon. Ce n’est donc pas parce que le patient est leucémique qu’on ne peut pas conserver son tissu. Il convient de préserver dès aujourd’hui les tissus et de voir par la suite ce que le progrès nous réserve.
TRANSPLANTATION DE CELLULE
Il est difficile d’extraire les cellules du tissu, car il faut connaître le marqueur des cellules souches.
L’amplification par culture in vitro est peu efficace chez l’humain. Pour y parvenir, il sera nécessaire de mettre au point les techniques de culture. Cela passe par une connaissance des facteurs de croissance de la cellule, en identifiant les gènes exprimés par la cellule. Les données d’innocuité chez l’animal sont rassurantes. Cette technique présente un fort potentiel de décontamination de la maladie résiduelle, car seules les cellules souches sont réinjectées.
SPERMATOGÉNÈSE IN VITRO
De nombreuses techniques de bio-ingénierie sont utilisées pour améliorer les conditions de culture in vitro. Le processus ne fonctionne pas encore chez l’homme, mais des progrès devront être réalisés car il s’agira de la seule technique possible lorsque le prélèvement sera contaminé.
PROJETS DE RECHERCHE
Le docteur Barrault-Lange travaille avec l’Inserm Cochin en collaboration avec le CEA. Dans le cadre du programme GermCell, il est proposé aux parents que l’enfant malade cède à la recherche un fragment de tissu testiculaire. Si au moins 10 fragments ont pu être fabriqués, l’un d’entre eux est destiné à la recherche.
BUT DU PROJET
– Caractériser et isoler les CSS prépubères humaines :
Association de marqueurs
Fraction hautement enrichie en CSS
– Amplifier / Transplanter les CSS :
Culture In vitro : autorenouvèlement sans différenciation
In Vivo : xénotransplantation
– Mettre au point un modèle de greffe
Un court film est présenté : microscopie à feuillet de lumière par transparisation.
La lumière découpe le prélèvement, il est alors possible de reconstituer les coupes en 3D. Ce procédé permet d’observer le cœur des tubes pour voir comment s’organisent les cellules souches et ainsi comprendre comment elles fonctionnent, pour leur offrir l’environnement idéal in vitro.
Le Dr Barrault-Lange remercie le Pr Catherine Poirot, qui lui a permis d’avoir accès à ses patients enfants. Elle remercie également le CECOS Cochin : Pr Catherine Patrat, Pr Jean-Philippe Wolf, Dr Véronique Drouineaud et Dr Céline Chalas ; l’Institut de Radiobiologie Cellulaire et Moléculaire CEA-Inserm : Dr Fouchet, Dr Riou, Dr Gille (doctorante).
QUESTIONS COMPLÉMENTAIRES
Existe-t-il une coordination au niveau national ? Quelle est la source du soutien financier ?
Il n’y a pas de coordination au niveau national. Deux équipes en France travaillent sur la recherche. Concernant le soin, toutes les grandes villes disposent de laboratoires pouvant congeler le sperme. Il convient cependant de réaliser un travail de sensibilisation auprès des soignants à propos de la préservation des tissus des jeunes enfants, pour que ces derniers puissent plus tard bénéficier du traitement (toujours au stade expérimental).
Nous ne savons pas évaluer le risque sur la fertilité avec certitude, mais les techniques de préservation ne sont pas proposées en cas de risque modéré, en raison de leur caractère invasif. L’intervention est proposée seulement s’il est estimé que le patient présente plus de 90% de chances d’être stérile à l’âge adulte.
La recherche fondamentale est financée uniquement par le secteur public. Je suis personnellement salariée de l’APHP (Assistance Publique Hôpitaux de Paris) et de l’Education Nationale. L’ANR (Agence Nationale de Recherche) finance les recherches depuis 2014, sous forme d’appels d’offres. Nous sommes également partenaires avec l’association Laurette Fugain, entres autres. Il demeure en tout cas très difficile d’obtenir des financements.
Le Téléthon pourrait-il financer les recherches ?
Ces recherches se situent sur une niche : leur impact est fort à titre individuel, mais peu d’enfants sont concernés. La fertilité s’inscrit dans la qualité de vie après le cancer. Or les soins de confort demeurent souvent relégués au second plan par les pouvoirs publics. Ces derniers devront réaliser des arbitrages.
Quid des laboratoires privés ?
Ils ne sont pas intéressés en raison des faibles retombées commerciales.
Quel est le public visé ?
Tous les patients devant subir une chimiothérapie à haut risque de conditionnement pré-greffe sont potentiellement concernés : leucémie, drépanocytose, leucodystrophie, aplasie médullaire, etc. Les patients atteints de tumeurs solides nécessitant une intensification thérapeutique à haut risque pour la fertilité peuvent également être visés.
Quel est le risque de transmission génétique de la maladie ?
Une des applications possibles de cette technique serait de modifier génétiquement la cellule souche avant de la transplanter. Or la manipulation génétique demeure pour l’heure interdite en France. Une fois qu’elles seront maîtrisées, il conviendra de faire bon usage de ces techniques, en raison de leur considérable puissance d’application.
Quelles sont les techniques équivalentes chez la fille ?
Un ovaire entier est prélevé, celui-ci représente un énorme potentiel en termes de quantité de tissu. De nombreux progrès ont été réalisés dans ce domaine. La technique consiste à regreffer une partie de l’ovaire dans le ventre. Aujourd’hui, environ 300 enfants sont nés dans le monde à partir d’une greffe de cortex ovarien congelé. Dans le cadre de l’expérience du Pr Poirot, la moitié des femmes ont conçu naturellement : les fragments d’ovaire ont été regreffés au bon endroit et la fertilité a été retrouvée.
En revanche, la greffe n’est pas possible si l’ovaire est contaminé par une cellule malade. Dans ce cas, il convient de réaliser une folliculogénèse in vitro pour faire mâturer l’œuf dans l’ovaire. Nous ne savons pas encore le réaliser chez l’humain, mais il convient malgré tout de conserver l’ovaire. A ce propos, du tissu immature est d’ores et déjà conservé chez les petites filles. Pour l’instant en France, aucun cas de réutilisation de tissu immature pour restaurer la fertilité chez la femme n’a été observé. Il convient d’attendre que les petites filles deviennent adultes. Il est par ailleurs possible de réutiliser le tissu pour induire une puberté. Enfin, une publication dans le monde fait état de la réutilisation de tissu immature ayant débouché sur une naissance.